Ricerca scientifica e mondo imprevisto: perché la ricerca di base è essenziale
Durante l’ultima estate della seconda guerra mondiale Vannevar Bush , che era a capo dell’Ufficio per la ricerca e lo sviluppo scientifico della Casa Bianca, scrisse un rapporto per il presidente Truman che intitolò Science, the Endless Frontier. Il rapporto è stato recentemente ripubblicato con un capitolo introduttivo da Rush Holt, Jr , un fisico ed è stato membro del Congresso per 8 mandati del New Jersey dal 1999 al 2015. Sebbene Vannevar Bush fosse principalmente un ingegnere, apprezzava che scienza, ingegneria e tecnologia siano non uno e lo stesso, ma che ciascuno dipende dall’altro. Science, the Endless Frontier era un brief approfondito per la ricerca scientifica di base, che spiegava perché il sostegno del governo alla scienza fosse una componente essenziale che contribuisce al benessere di tutti.
Un risultato importante del rapporto Bush fu la creazione della National Science Foundation (NSF) nel 1950, seguita dalla trasformazione di quello che iniziò come Hygienic Laboratory nel 1887 nei National Institutes of Health (NIH) che conosciamo oggi, con i suoi 27 centri e istituti separati e un budget di 42 miliardi di dollari nel 2020. Mentre la Guerra Fredda tendeva a sovvertire alcune priorità, argomento per un’altra volta, l’età dell’oro della scienza americana dagli anni ’50 agli anni ’90 era reale. Sebbene ci siano stati alti e bassi associati ai vincoli di bilancio e alla politica, e ci sia sempre stato qualche registro tra i prescelti, entrambe le agenzie hanno finanziato quella che Karl Popper avrebbe chiamato “buona scienza”, che era diretta a rispondere a domande interessanti su ciò che una volta veniva chiamata “storia Naturale.”
Sono un biologo per temperamento e vocazione, e in questo articolo racconterò brevemente una storia di ricerca biologica che oggi sarebbe caratterizzata da revisori e responsabili di programma presso agenzie di finanziamento che utilizzano l’epiteto killer “descrittivo”, ma che tuttavia ha portato alla consapevolezza che rivoluzionarono la biologia cellulare in modi straordinari e del tutto imprevedibili.
La bioluminescenza, l’emissione di luce da parte degli organismi viventi, fu descritta da Aristotele e successivamente apparve spesso nella letteratura di storia naturale fino al XIX secolo .[1]
Nel corso del XX secolo, questo affascinante aspetto della storia naturale ha ceduto agli approcci biochimici, quando scienziati negli Stati Uniti, in Europa e in Giappone hanno sviluppato una comprensione della natura chimica della “luce fredda” e hanno spiegato “come” funziona la bioluminescenza nei batteri, protisti, funghi e animali[2]. Il “perché” evolutivo della bioluminescenza non è ben compreso nella rete della vita ed è ancora per lo più una questione in sospeso, anche se è chiaro che la rana pescatrice delle profondità marine usa le sue esche piene di batteri bioluminescenti per attirare le prede nelle profondità oceaniche più oscure.
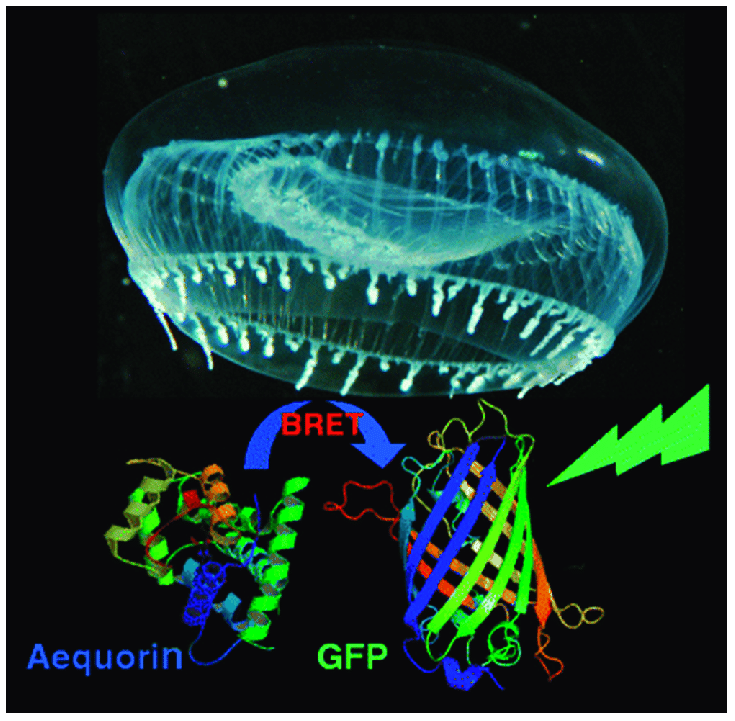
A livello biochimico, la bioluminescenza è meglio compresa nei batteri, nelle lucciole e negli invertebrati marini, tra cui vari Cnidaria (celenterati, inclusi coralli duri e molli e meduse) e Ctenophora (gelatine a pettine). Questi ultimi sono considerati tra i primi animali divergenti, con un attuale riferimento ai ctenofori, quindi è probabile che la bioluminescenza sia un antico attributo degli animali, sebbene limitato nella distribuzione tra gli organismi esistenti. Qui ci concentreremo sulla medusa Aequorea victoria e sulla viola del pensiero Renilla reniformis , perché i meccanismi di bioluminescenza in questi organismi sono simili e sono stati descritti in dettaglio.

Senza entrare troppo nei dettagli biochimici, i punti chiave, che furono elaborati in una serie di articoli dalla fine degli anni ’50 fino agli anni ’80, principalmente dai gruppi di ricerca guidati da Milton J. Cormier ( Renilla ), Frank H. Johnson e Osamu Shimomura ( Aequorea ), sono
Questa luce blu viene prodotta nella provetta con componenti purificati. In ciascun organismo, tuttavia,
E per molto tempo la domanda è stata: “Come funziona?” Per farla breve, per l’emissione di luce nell’organismo è necessaria un’altra proteina: la proteina fluorescente verde, o GFP. L’energia rilasciata durante l’ossidazione della luciferina viene trasmessa direttamente alla GFP, che poi emette luce verde.
Dopo che la biochimica e la biofisica della bioluminescenza dei celenterati furono elaborate utilizzando componenti purificati alla vecchia maniera dalla viola del pensiero e dalle meduse raccolte nei laboratori marini, i biochimici che facevano la ricerca fecero la cosa successiva: divennero biologi molecolari e clonarono i geni per Renilla luciferasi , Aequorea GFP e aequorina ( qui e qui ). L’equorina è il complesso luciferasi-luciferina-ossigeno precaricato, attivato per emettere luce dopo il legame con gli ioni Ca 2+ .
La disponibilità di queste versioni ricombinanti di ciascuna proteina ha portato al loro utilizzo come strumenti nella biologia molecolare e cellulare. La luciferasi ricombinante fu presto utilizzata per misurare l’espressione genica in tempo reale nelle cellule in cui era presente una luciferasi/gene di interesse chimerico semplicemente aggiungendo luciferina al mezzo di coltura e misurando l’emissione luminosa in condizioni sperimentali. L’equorina purificata dalla medusa è stata a lungo utilizzata come indicatore del calcio negli studi sulla contrazione muscolare e sulla propagazione dei segnali nelle cellule nervose , ma la disponibilità dell’equorina ricombinante ha reso possibile estendere la portata di questa tecnica senza la necessità di purificare l’equorina nativa, le proteine dalla medusa e poi microiniettandole manualmente nelle cellule. Come con la Renilla luciferasi, è diventato possibile preparare cellule che esprimono aequorina ricombinante e misurare i flussi di calcio senza microiniezione.
Questi benefici derivanti dalla ricerca sulla bioluminescenza dei celenterati hanno rappresentato importanti progressi. L’emissione di luce è facile da misurare e, in prima approssimazione, è possibile determinare la localizzazione della molecola che emette luce (aequorina o equorina chimerica/proteina di interesse) in una cellula, tessuto o organismo.
Ma Aequorea GFP era inaspettatamente destinata a essere il risultato più importante di questa ricerca. Poco dopo aver pubblicato il suo lavoro sulla clonazione e sulla sequenza del gene GFP, Doug Prasher ha incontrato Martin Chalfie e ha condiviso il suo clone GFP. Chalfie ha poi espresso l’Aequorea GFP nel batterio Escherichia coli e nel nematode Caenorhabditis elegans , e il resto è storia. Dall’abstract di quell’articolo:
Un DNA complementare per la proteina fluorescente verde (GFP) di Aequorea victoria produce un prodotto fluorescente quando espresso in cellule procariotiche (Escherichia coli) o eucariotiche (Caenorhabditis elegans). Poiché per questa fluorescenza non sono necessari substrati e cofattori esogeni, l’espressione della GFP può essere utilizzata per monitorare l’espressione genica e la localizzazione delle proteine negli organismi viventi (enfasi aggiunta).
GFP, nome prosaico che ha, è semplicemente una meraviglia della natura. La proteina si ripiega spontaneamente nella sua conformazione tridimensionale nativa. Inoltre, la proteina è notevolmente stabile. Pertanto, un gene di interesse ricombinante contenente GFP a un’estremità o all’altra viene facilmente espresso in cellule di tutti i tipi, dai batteri alle cellule staminali umane, e la posizione di questa proteina contenente GFP può essere identificata con precisione utilizzando un microscopio a fluorescenza, in tempo reale nelle cellule viventi .
Dalla clonazione dell’Aequorea GFP questa è apparsa in oltre 45.000 pubblicazioni, tanto che la biologia cellulare senza l’uso della GFP è difficilmente immaginabile. Dopo che la GFP fu utilizzata per la prima volta, Roger Tsien iniziò a produrre GFP in diversi colori, e ora possiamo usare varie tonalità di “GFP”, che vanno dal blu intenso al rosso, spesso utilizzate nella stessa cellula mentre studiamo la funzione di proteine distinte. Pertanto, Osamu Shimomura ha prima purificato e inizialmente caratterizzato la GFP dalle meduse; Doug Prasher successivamente clonò il gene e lo diede a Martin Chalfie, il quale dimostrò che la GFP poteva essere utilizzata come marcatore dell’espressione proteica praticamente in tutte le cellule viventi. Roger Tsien dell’Università della California-San Diego ha successivamente sviluppato la GFP in più colori. Dott. Shimomura, Chalfie e Tsien hanno ricevuto il Premio Nobel per la Chimica nel 2008 in riconoscimento del loro lavoro, che ha rivoluzionato la ricerca nella biologia cellulare.
Perché questo è interessante, per me e per altri biologi e per coloro che sono interessati alla ricerca scientifica come uno dei nostri metodi utili per comprendere il mondo che ci circonda? Perché la ricerca su cui si è basata questa rivoluzione si è sviluppata direttamente dalla visione di Vannevar Bush della ricerca di base, che dovrebbe essere finanziata e sostenuta in assenza di un obiettivo particolare. Questa ricerca non aveva alcuna giustificazione strumentale, se non quella di comprendere un interessante enigma di storia naturale. Nessuno avrebbe mai potuto immaginare dove ci avrebbero portato i primi finanziamenti della NSF a Osamu Shimomura, Frank Johnson, Milton Cormier e molti altri.
Quello era davvero un mondo diverso. Le attuali linee guida del NSF Cellular Dynamics and Function Cluster , che potrebbero essere una probabile fonte di finanziamento per la ricerca sulla bioluminescenza, sono qui:
Il cluster cerca indagini basate sulla teoria di diversi sistemi cellulari e subcellulari. Sono incoraggiate proposte di ricerca che utilizzino approcci fisici, chimici, matematici e computazionali multidisciplinari per fornire nuove tecniche e informazioni integrative sulle funzioni cellulari fondamentali. Sono incoraggiate proposte innovative che utilizzano piante, microbi e specie modello non tradizionali. Alle proposte che fanno molto affidamento su approcci descrittivi viene data una priorità inferiore.
Il cluster incoraggia proposte nelle seguenti aree:
Il cluster riconosce che il progresso tecnologico può avere influenze profonde e catalitiche nel campo della biologia cellulare. Questi progressi sono spesso il risultato del fatto che la tecnologia di un campo scientifico viene presa in prestito e applicata ad un altro in modi nuovi e creativi. Il cluster incoraggia proposte per sviluppare o adattare strumenti innovativi con il potenziale per consentire nuove vie di ricerca cellulare.
Questa è un’insalata di parole della peggior specie, che rivaleggia con quella del tipico politico americano (che a pensarci bene, NSF ha un suffisso .gov). La descrizione in Systems and Synthetic Biology potrebbe essere peggiore. Ma analizziamo un po’ di questo.
Indagini guidate dalla teoria. La teoria è negli occhi di chi guarda e le teorie in biologia hanno un passato mediocre. Questo in particolare mi ricorda la “biologia assiomatica” sviluppata da JH Woodger negli anni ’30,[3]durante uno dei periodici e prolungati attacchi di invidia fisica e ingegneristica della biologia. A parte la teoria dei geni, il dogma centrale della biologia molecolare e la sintesi moderna della biologia evoluzionistica, la biologia è troppo granulare, vale a dire che le molecole e le cellule biologiche hanno una storia evolutiva significativa di quasi 3 miliardi di anni, per grandi teorie generali di qualsiasi tipo.
Multidisciplinare. L’interdisciplinarietà, forse, ma del resto tali collaborazioni e fusioni raramente funzionano, soprattutto se forzate, sebbene siano apprezzate dai politici. Nuove tecniche e approfondimenti integrativi…strumenti innovativi con il potenziale per abilitare nuove strade di indagine cellulare. Chiunque proponga qualcosa di veramente nuovo o innovativo in una proposta di finanziamento alla NSF rimarrà deluso dall’inevitabile versione di “non ha dimostrato di poterlo fare o che funzionerà” da parte di almeno un revisore. Uno è abbastanza. E di solito è il Revisore numero 3.
E ora il mio preferito: alle proposte che fanno molto affidamento su approcci descrittivi viene data una priorità inferiore. Penso che abbiano dimenticato “ incrementale ”, che è il gemello di “ descrittivo ” nell’universo di disprezzo del responsabile del programma/revisore delle proposte. Sottolineerò semplicemente che nessuna delle solide ricerche che hanno portato alla rivoluzione nella biologia cellulare qui descritta avrebbe soddisfatto gli standard dell’attuale NSF. L’obiettivo di quegli scienziati 50-60 anni fa era comprendere la natura, a qualunque livello appropriato perseguissero.
Poiché la biologia non è riconducibile alla “teoria” se non nei contesti più banali, praticamente tutta la ricerca biologica è principalmente descrittiva. È anche incrementale. I progressi sono pochi e rari, compresa la struttura del DNA, anche se James Watson in La doppia elica ha fatto del suo meglio per renderlo tale per il DNA e quasi ci è riuscito.
Altri importanti progressi nella biologia degli ultimi 50 anni che sono stati “descrittivi e incrementali” includono la nostra comprensione del ciclo cellulare , che è stata elaborata utilizzando lieviti e invertebrati marini come organismi sperimentali dopo che l’uso di cellule e modelli “superiori” si è rivelato infruttuoso. La prima mappa della linea cellulare di un organismo multicellulare è stata realizzata utilizzando il nematode C. elegans, e ciò ha portato alla scoperta della morte cellulare programmata (apoptosi), che è l’obiettivo di gran parte della terapia contro il cancro.
Ogni studente di biologia delle scuole superiori conosce l’importanza del moscerino della frutta nello sviluppo della genetica, ma i geni responsabili della formazione del modello praticamente in ogni animale sono il risultato della ricerca condotta da uno scienziato indipendente, in gran parte solitario, che descrisse moscerini della frutta dall’aspetto strano . Come ha sottolineato Joram Pitiagorsky diversi anni fa, coloro che sono responsabili della scelta dei vincitori e dei perdenti in quella che è diventata la Great Grant Lottery, dai politici ai revisori fino ai funzionari del programma, dovrebbero ricordare sempre che le risposte alle domande biologiche non possono essere conosciute in anticipo – lì non è l’equivalente biologico del bosone di Higgs – e che le risposte a queste domande spesso portano a progressi nella conoscenza scientifica e nella pratica scientifica, tanto inimmaginabili e imprevedibili quanto rivoluzionari.
C’è una via da seguire per la biologia? Sì, ma le cose devono cambiare. Nei miei primi due contributi a questa serie mi sono imbattuto senza dubbio in una persona disincantata dalla scienza. Nulla potrebbe essere più lontano dalla verità.
Ma ho visto scienza buona, scienza cattiva e scienza indifferente in una carriera iniziata come lavapiatti in un laboratorio didattico. Spero di aver contribuito al primo di questi, e non ho dubbi di aver preso parte ad alcuni dei secondi. Tuttavia, sto per infrangere la Legge di Horowitz, così chiamata in onore del mio professore introduttivo di sociologia quando ero una matricola, molti anni fa: “Non generalizzare mai sulla tua esperienza limitata!”
Horowitz aveva ragione e il suo insegnamento mi è stato utile per 40 anni. Ma la mia esperienza è ormai estesa a tutti i livelli di ricerca nelle scienze biomediche. Quando iniziarono i primi lavori sulla bioluminescenza qui descritti, i comitati di revisione delle sovvenzioni si incontrarono per decidere quali domande non finanziare. Ciò non significa che ottenere il sostegno finanziario sia mai stato facile. Ma c’è stato un tempo in cui le aspettative positive erano ragionevoli, quando la parola “finanziamento” non esisteva.
Ho scritto ed esaminato richieste di sovvenzione per più di 30 anni e, più recentemente, ho ricoperto per 10 anni il ruolo di co-presidente e presidente di un comitato di revisione nazionale di un’importante agenzia di finanziamento. Durante questo periodo, mi è diventato chiaro che un comitato di revisione può (possibilmente) decidere quali domande si trovano nel terzo superiore del pool e dovrebbero essere finanziate e quali si trovano nel terzo intermedio e dovrebbero essere finanziate dopo la revisione. Una percentuale di successo del 67% è più o meno giusta. La maggior parte degli scienziati hanno una mentalità seria e sono disposti a lavorare sodo. Preparare una domanda di assegno di ricerca è sicuramente un lavoro duro che può richiedere un anno o più. Quelli nel terzo inferiore rimarranno senza speranza per tutta la durata.
È difficile stabilire tassi di successo credibili per le principali agenzie di finanziamento pubblico perché le definizioni dei premi per la ricerca sono talvolta incommensurabili tra loro. Ma al NIH la recente linea di pagamento per le sovvenzioni di progetti di ricerca extramurali è del 20% circa. O meglio, come dovremmo vederla: l’80% di tutte le proposte di ricerca rimangono in purgatorio. In alcuni istituti il tasso di successo è a una cifra. Ho un caro collega che sta facendo alcune ricerche molto promettenti sul cancro. Con la linea di pagamento dell’8-9% presso il National Cancer Institute, lei, come persona che non è già membro del club, non ha praticamente alcuna possibilità.
I costi opportunità di tassi di successo così bassi non sono calcolabili, ma sono elevati. Cosa ci perdiamo scegliendo i vincitori in anticipo, classificando una sovvenzione nel 5% più alto mentre non c’è differenza tra quella domanda e quella che si colloca nel 30% più alto? Se l’attuale progetto neoliberista avesse regnato negli anni ’50, la bioluminescenza di oscuri animali “primitivi” sarebbe stata finanziata? Probabilmente no. Qualcuno avrebbe mai capito che la GFP di una medusa potrebbe essere utilizzata come strumento indispensabile nella biologia cellulare? Probabilmente no.
Quindi la soluzione a questo problema è simile alla soluzione della cosiddetta medicina basata sull’evidenza : ricerca scientifica finanziata con una mente aperta e aspettative disinteressate. Alcune ricerche produrranno risultati indifferenti o addirittura nessun risultato. Naturalmente lo farà. Ma per alcuni sarà rivoluzionario. Non possiamo sapere quale in anticipo.
E nel lungo termine, sarà meno costoso avere una NSF allargata e un NIH (sì, possiamo permetterceli entrambi) che finanziano le idee che non funzionano assicurandosi al tempo stesso che quelle che funzioneranno abbiano la possibilità che meritano.
Come nota finale, mentre esaminavo la letteratura a cui si fa riferimento qui, ho notato che i gruppi di ricerca che hanno svolto il lavoro erano spesso piccoli e il numero di pubblicazioni da parte dei ricercatori principali non era ridicolosamente ampio. C’è qualcosa in questo, a cui allude Karl Popper : “I miei dubbi riguardo al progresso scientifico e alla stagnazione derivano principalmente dal mutato spirito della scienza e dalla crescita incontrollata della Big Science (inclusa certamente la Big Pharma), che mette in pericolo la grande scienza.” Questa grande scienza è spesso svolta da gruppi molto piccoli di individui impegnati.
Se noi, come nazione, intendiamo seriamente ricostruire meglio, questo è uno dei tanti buoni punti di partenza.
Note
[1]E. Newton Harvey, Una storia della luminescenza dai primi tempi fino al 1990 . Filadelfia: The American Philosophical Society, 1957. Bioluminescenza , New York: Academic Press, 1952.
[2]FH Johnson e Y. Haneda, eds. Bioluminescenza in corso , Princeton: Princeton University Press, 1966; PJ Herring, ed. Bioluminescenza in azione , New York: Academic Press, 1978.
[3] Il metodo assiomatico in biologia (1937). Sì, l’ho letto per quanto possibile. È passato molto tempo, ma la notazione mi ha ricordato i Principia Mathematica di Bertrand Russell e Alfred North Whitehead. Una biblioteca con scaffali aperti in un’importante università di ricerca è una meraviglia del mondo moderno.
Autore
KLG, che ha ricoperto incarichi di ricerca e accademici in tre scuole di medicina statunitensi dal 1995 ed è attualmente professore di biochimica e preside associato. Ha eseguito e diretto ricerche sulla struttura, funzione ed evoluzione delle proteine; adesione e motilità cellulare; il meccanismo di fusione delle proteine virali; e assemblaggio del cuore dei vertebrati. Ha fatto parte di gruppi di revisione nazionali di agenzie di finanziamento pubbliche e private, e la sua ricerca e quella dei suoi studenti sono state finanziate dall’American Heart Association, dall’American Cancer Society e dal National Institutes of Health.
Fonte: nakedCapitalism
 https://www.asterios.it/catalogo/gaia-universalis
https://www.asterios.it/catalogo/gaia-universalis